医療AIと幹細胞・リプログラミング技術による細胞老化克服の最前線
イントロダクション:次世代医療の革新技術
現代医学において医療AI、幹細胞リプログラミング技術、細胞老化制御の分野は急速な進歩を遂げており、これらの融合により革新的な治療法が次々と開発されています。特に皮膚老化におけるステムセルエイジングの解明や、p16INK4a高発現細胞を標的とした治療技術、発がん過程におけるエピゲノム制御メカニズムの理解は、従来の医療概念を根本から変える可能性を秘めています。
医療AIによる細胞解析技術の革新
最新の医療AI診断支援システム
2024年から2025年にかけて、医療分野におけるAI技術の応用は飛躍的に進歩しています。医療AI市場は約165億ドルから2034年までに約450億ドルに成長すると予測されており、年平均成長率12.5%という驚異的な拡大を見せています。
重要な技術進歩として:
IBM Watsonによる医療情報処理では、推奨の90%が適切で、処理時間はわずか40秒という画期的な効率性を実現しています。これにより、医療従事者は膨大な患者データから重要な情報を迅速に抽出し、より精密な診断が可能になっています。
AI技術による細胞老化解析の最前線
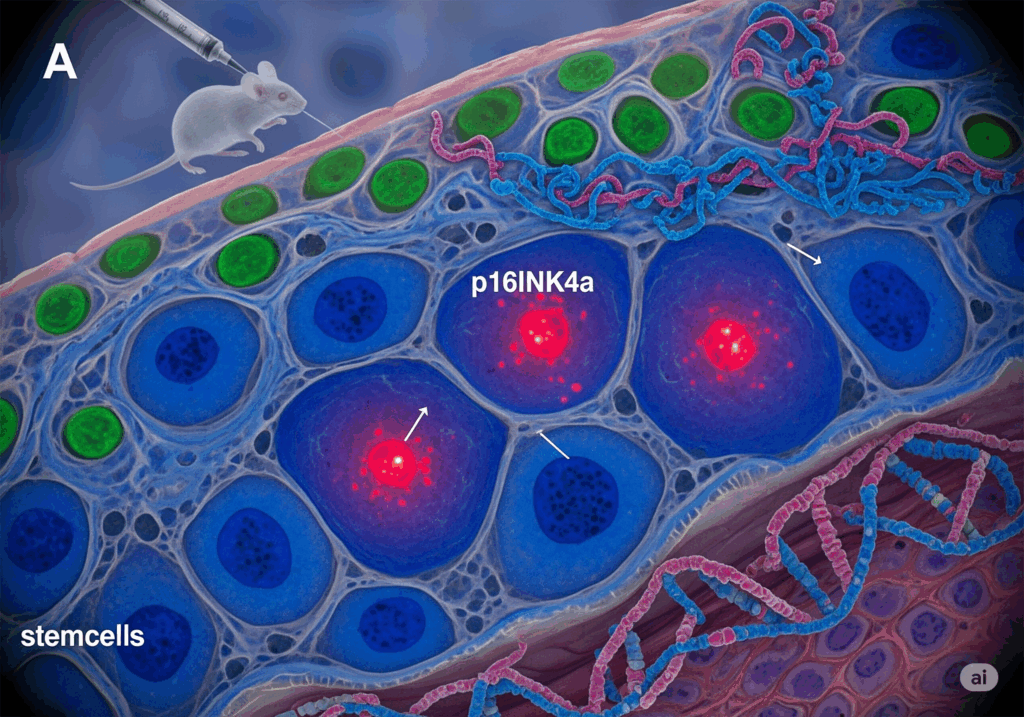
医療AIは細胞老化マーカーの解析において革命的な進歩をもたらしています。特にp16INK4a陽性細胞の検出や追跡において、従来の手法では困難だった高精度な解析が可能になっています。
幹細胞・リプログラミング技術の最新動向
山中因子による細胞若返り技術
幹細胞リプログラミング技術は、2006年の山中伸弥教授による発見以来、急速な発展を遂げています。2016年に米国ソーク研究所で実施された研究では、山中の4遺伝子(OSKM)の一時的導入により、マウス個体レベルでの細胞の若返りと寿命延伸効果が確認されました。
重要な研究成果:
スイスのローザンヌ大学グループによる最新研究では、OSKM遺伝子群の長期誘導について検討され、肝臓と小腸での発現抑制により延命効果が得られることが示されています。
直接リプログラミング技術の進歩
2025年には直接リプログラミング技術により、マウス肺細胞の迅速作製に成功するなど、幹細胞を介さない新たなアプローチも実用化に向かっています。これらの技術は、従来の分化転換プロセスを大幅に短縮し、より効率的な細胞治療を可能にします。
皮膚老化とステムセルエイジングの分子機構
皮膚幹細胞の老化プロセス
皮膚老化におけるステムセルエイジングの研究では、表皮幹細胞の分裂不均一性が重要な役割を果たしていることが明らかになっています。九州大学生医研の佐田研究室による最新研究では、加齢に伴う幹細胞の機能低下を細胞・分子レベルで解明し、老化制御の新戦略創出を目指しています。
皮膚老化の主要メカニズム:
大正製薬の研究では、細胞老化が肌のバリア機能低下を誘導し、特に結合型セラミドの著しい減少が確認されています。これらの発見により、加齢による肌の乾燥メカニズムの解明が大きく前進しました。
老化細胞の蓄積と除去メカニズム
「お肌の曲がり角」として知られる30歳前後の皮膚機能低下は、実際に老化細胞の蓄積と密接な関係があることが科学的に証明されています。日本メナード化粧品の研究により、表皮と真皮の両方で老化細胞の増加が30歳頃から加速することが明らかになりました。
重要な発見:
p16INK4a高発現細胞の追跡・除去技術
遺伝子改変マウスモデルの開発
p16INK4a高発現細胞を標的とした研究では、革新的な遺伝子改変マウスモデルが開発されています。国立長寿医療研究センターの研究では、p16INK4aをコードするCDKN2A遺伝子に可視化マーカーを組み込んだモデルマウスを作製し、老化細胞の検出と除去を可能にしています。
INK-ATTACマウスは、化合物AP20187の投与により、p16INK4a発現細胞でカスパーゼ8を活性化させ、老化細胞を選択的に除去できる画期的なシステムです。このモデルは2011年にBakerらにより作製され、現在も多くの研究で活用されています。
老化細胞の可視化技術
最新の研究では、tdTomatoやhCD2などのマーカー分子を用いて、老化細胞の生体内可視化が可能になっています。特にink4A-dTomato_DTR マウスでは、自然加齢による皮膚組織内の老化細胞の検出と除去が実現されています。
セノリティクス:老化細胞除去療法の臨床応用
セノリティクス薬剤の最新動向
セノリティクス(Senolytics)は老化細胞を選択的に除去する革新的治療薬として注目されています。最新の臨床研究では、既存の糖尿病治療薬であるSGLT2阻害薬が老化細胞除去薬として機能することが発見され、アルツハイマー病などの加齢関連疾患への応用が期待されています。
主要なセノリティクス薬剤:
| 薬剤名 | 作用機序 | 臨床状況 |
|---|---|---|
| ダサチニブ | チロシンキナーゼ阻害、造血系老化細胞除去 | FDA承認済(白血病治療) |
| ケルセチン | 抗酸化・抗炎症・老化細胞除去 | 天然フラボノイド、サプリ流通 |
| フィセチン | SASP抑制・アポトーシス誘導 | 臨床試験進行中 |
| SGLT2阻害薬 | 免疫チェックポイント分子制御による除去促進 | 糖尿病薬として実用化済 |
セノリティクス療法の治療効果
マウス実験では、老化細胞除去により寿命が20〜30%延長し、運動能力、皮膚再生、心臓・腎機能の著しい改善が確認されています。ヒトの臨床試験も初期段階にあり、ダサチニブ+ケルセチンの組み合わせによる肺線維症、慢性腎疾患、糖尿病関連疾患での有効性検討が進行中です。
発がん過程における細胞老化様反応とエピゲノム制御
エピゲノム制御による発がん抑制機構
細胞老化は発がんの重要な抑制機構として機能しており、特にエピゲノム制御が重要な役割を果たしています。京都大学iPS細胞研究所の研究では、細胞・組織ごとに異なるエンハンサー領域の違いが、細胞老化誘導の違いと腫瘍形成の差異を生み出すことが明らかになりました。
重要な研究成果:
研究では、同一の遺伝子変異を持つにも関わらず、末梢神経細胞のみが細胞老化を回避できることが発見されています。この発見により、がん細胞のエピゲノムを標的とした新たな治療法開発への道が開かれました。
細胞老化による発がん抑制の個体レベル解析
p53/p21経路およびp16INK4A/Rb経路の活性化を介した細胞周期停止が、細胞老化の決定的特徴として機能します。これらの経路は、テロメア短縮、がん遺伝子活性化、DNA損傷に応答して活性化され、がん化を防ぐ重要な機構となっています。
免疫系による老化細胞除去機構
CD4 CTLによる老化細胞排除システム
資生堂とマサチューセッツ総合病院皮膚科学研究所の共同研究により、皮膚の免疫細胞が老化細胞を除去する革新的なメカニズムが発見されました。**Cytotoxic CD4+ T細胞(CD4 CTL)がヒトサイトメガロウイルス(HCMV)**を目印として老化細胞を選択的に除去することが世界で初めて明らかになりました。
免疫系による老化細胞除去の特徴:
この発見は、従来考えられていた「加齢とともに老化細胞が単純に蓄積する」という概念を覆し、生体が持つ自然な老化対策機構の存在を示しています。
幹細胞疲弊の分子機構
染色体構造変化と遺伝子発現制御
理化学研究所の最新研究では、個体老化に伴う幹細胞疲弊の分子機構が解明されています。ショウジョウバエの腸幹細胞を用いた研究により、Trl転写因子で制御される染色体領域が老化に伴い閉鎖し、関連遺伝子の発現低下により細胞疲弊が起こることが発見されました。
幹細胞疲弊の主要メカニズム:
この研究成果は、老化による幹細胞機能低下の根本的メカニズム理解に重要な知見を提供し、将来的なアンチエイジング治療への応用が期待されます。
再生医療における最新技術統合
次世代再生医療プログラムの展開
日本医療研究開発機構(AMED)が推進する**「再生・細胞医療・遺伝子治療実現加速化プログラム」**では、これらの革新技術を統合した包括的なアプローチが実施されています。2025年度も継続的に研究課題が採択され、基礎研究から臨床応用まで幅広い展開が進行中です。
プログラムの重点領域:
臨床応用への展望
現在、多くの医療機関で幹細胞治療の臨床応用が開始されています。ブレインケアクリニックでは認知症、コロナ後遺症、脳老化に対する幹細胞上清液治療が実用化され、1日数回の鼻腔内スプレー投与という手軽な治療法が提供されています。
今後の展望と課題
技術統合による革新的治療法の開発
医療AI、リプログラミング技術、セノリティクス療法の統合により、従来不可能だった精密な老化制御が実現しつつあります。特に以下の分野での進歩が期待されます:
重要な発展方向:
- AIによる個別化セノリティクス療法の最適化
- リプログラミング技術を用いた組織特異的若返り治療
- エピゲノム編集による発がん予防と老化抑制の同時実現
安全性と倫理的課題
一方で、細胞リプログラミングにおいては、ある経路の若返りが他の経路で老化を加速させる可能性も指摘されており、慎重な検討と多角的な研究が必要です。また、セノリティクス療法の長期安全性や、健康な細胞への影響についても継続的な評価が求められます。
まとめ:統合的アプローチによる次世代医療の実現

医療AI技術、幹細胞リプログラミング、細胞老化制御技術の融合により、従来の医学概念を大きく変える革新的治療法が次々と開発されています。p16INK4a高発現細胞の可視化・除去技術、エピゲノム制御による発がん抑制機構の解明、免疫系を介した老化細胞除去システムの発見など、基礎研究から臨床応用まで幅広い成果が得られています。
これらの技術統合により、個々の患者に最適化された精密老化制御医療の実現が近づいており、健康寿命の大幅な延伸と生活の質向上が期待されます。今後も継続的な研究開発と慎重な臨床評価を通じて、安全で効果的な次世代医療システムの構築が進められるでしょう。